Submit™平台提供了一整套集成的用于为合同研究组织(CROs)和委托单位创建和管理SEND数据集的和相关文档的工具和服务。
SEND格式使非临床数据更高效地审查,并提供更好的数据质量、可获得性和可预测性。该标准旨在提供一个更方便的媒介,将标准监管毒理学研究的大多数结果发送到监管部门。
用于向监管部门提交和毒理学数据电子转换的SEND标准对行业有着深远影响。现在,FDA颁布的非临床电子数据交换标准(SEND)强制要求以电子格式向法规机构申报数据的企业必须使用FDA所支持的标准、格式以及在FDA颁布的针对NDA、ANDA和特定的BLA申报所使用的FDA数据标准目录中定义的术语。如果不能按照要求进行申报将导致FDA技术性拒绝文件提交。因此,对企业来说,实现并遵从SEND数据申报标准是十分重要的。
除此之外,针对IND申报的SEND截止日期即将在2017年12月到来,而且一些新的研究类型诸如生殖毒理学以及安全药理也已经被添加到SEND标准中,可能被法规所采纳。
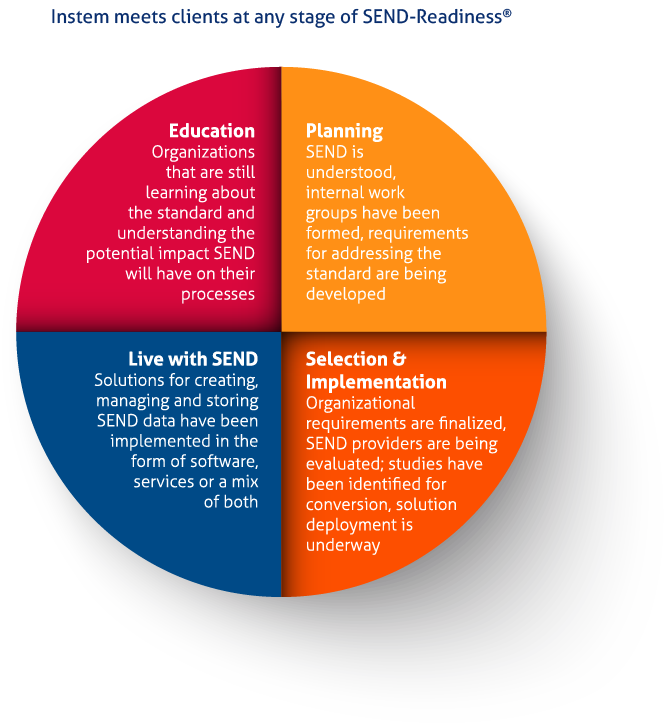
在这段变化时期里,委托单位和合同研究机构都面临着遵从SEND申报标准过程中一份不断增长的选择列表,其过程复杂难懂、尚未在市场得到完全验证且无法适应各个企业其SEND标准的认知和准备阶段。
鉴于多年来在支持企业准备并实施SEND申报标准的服务中所积累到的空前经验,Instem公司能够通过程序化、具有实践性并业已证明的解决方案,向处于不同认知准备阶段的企业提供清晰有效的SEND申报标准指导。Instem公司的申报工具以及外包服务现在已经成为全世界广泛采纳的SEND解决方案,目前已经在15个国家进行实施。
Submit 软件
Submit平台服务于SEND数据的创作者及使用者。它认为这两者之间没有显著的区别,因为很多企业在其自己的运营过程中既需要创作也需要使用SEND数据。 Submit平台同时也支持不同的需求范围,无论是大型的跨国制药企业及合同研究组织还是小型的生物技术企业以及咨询顾问公司都需要这一平台。
Submit™的特变和包括的功能:
|
无论您是想使用SEND来进行法规监管机构的数据提交从而推动您企业研发项目向前或是您要视其为对照以便更好地利用安全评价研究数据来产生新的看法, Submit都会提供您所需要的支持。我们的数据管理和分析产品及其精致,其设计不仅仅是为了支持法规监管部门查询数据,同样也允许用户进行数据挖掘。至于SEND工作流管理方面,它可以按照用户的要求来实现SEND数据自动化进入数据存储库和/或直接向法规机构进行提交的过程。
Submit 服务
将SEND引入到向FDA递交研究结果的过程既带来了机遇,也带来了挑战。Instem的SEND专家能够组织、教育并引导客户准备SEND实施、判断特定的策略确保其在遵循法规指导原则的前提下同样能够从SEND中获得其利益的最大化。
在SEND准备的每一个阶段,客户能够选择一项或多项方案服务,帮助客户完成走向符合SEND标准的旅程,同时将对机构的影响降到最低。这包括组织机构选择将他们SEND部门完完全全外包给Instem。