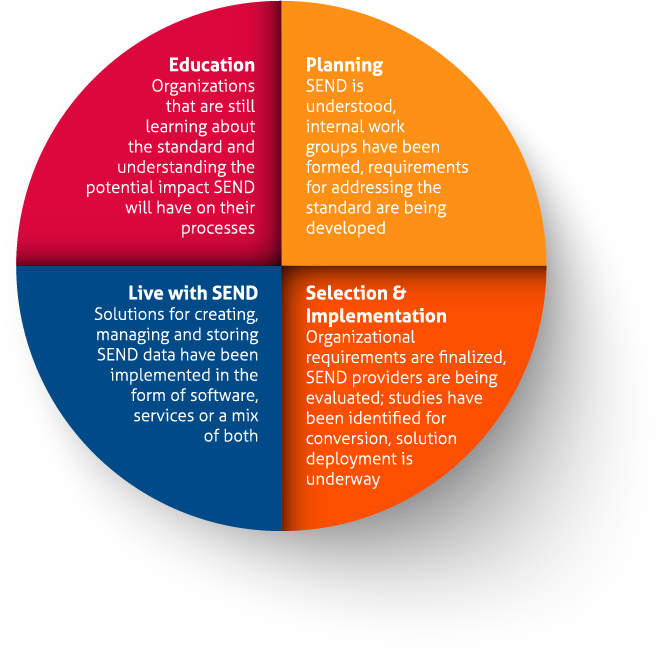
Originally driven by FDA’s Critical Path Initiative to bring medical breakthroughs more quickly to market, the SEND standard was developed under the auspices of CDISC (www.cdisc.org), a not-for-profit organization that establishes standards to support the acquisition, exchange, submission and archive of nonclinical and clinical research data and metadata. The CDISC mission is to develop and support global, platform-independent data standards that enable information system interoperability to improve medical research and related areas of healthcare.
SEND Status
On December 17, 2017, the latest FDA SEND Mandate for providing regulatory submissions in electronic format came into force. All organizations must now use the appropriate FDA-supported standards, formats and terminologies specified in the FDA Data Standards Catalog for NDA, ANDA, IND and certain BLA submissions.
Additionally, new study types, such as Reproductive Toxicology and Safety Pharmacology, have already been added to the SEND standard for future regulatory adoption.
SEND格式可以更有效地查阅临床前数据,提高数据质量、可读性和可预测性。
该标准是由委托方、CRO、和软件供应商代表组成的专家团队在过去的几年里开发出来的。它的设计目的是在向监管机构递交标准毒理学研究设计的结果时,提供一种递交工具。标准一直在不断开发中,以支持更多研究类型,以及在实际使用标准中产生的变化。

|
可用资源 |

该标准由三个主要部分构成:定义标准的结构(如域,变量等等),术语表词库(控制可变量使用的词条)和描述源数据和SEND数据集的元数据文件。术语由一个CDISC团队管理,并通过NIH的门户网站传播,每个季度都有新的词汇发布。
SEND在监管机构递交和毒理学电子数据交换标准的引入,对行业产生了重大影响。药物早期开发价值链中的每个组织现在都被这个标准的实现所打动,并且需要对它们的系统和工作实践进行更改。
您知道,如果不遵从SEND会导致文件被拒绝吗?
了解Instem如何帮助到您
Instem在在临床前毒理学领域已经拥有30多年的经验,并意识到向监管部门递交数据的SEND标准的实施会对所有提交给FDA的组织以及他们的供应商和顾问产生影响。第一次,所有的药物研发委托方需要拥有和管理电子数据,这些数据必须符合GLP(良好的实验室实践)和21 CFR第11部分的电子记录规定。
我们与制药公司、合同组织机构和法规监管部门的合作伙伴肩并肩的站在一起,从创建SEND之日起就投入时间和金钱。我们与SEND同行组织机构和FDA紧密合作,并且成为SEND行业团队中的一部分,帮助他们进一步指定标准并与行业实践保持一致。我们感到自豪的是,我们与最聪明、最具专注精神的人一起工作,帮助创建SEND标准。
CDISC已经认可Instem在完成SEND实施指南和帮助起草FDA发布的指南中发挥了关键作用,作出了杰出贡献。
行动吧,成为SENDReady™,现在与我们联系
您可以访问我们 submit™网页,请点击.